Равновесие в водном растворе аммиака, Справочник химика 21

Получить у лаборанта однонормальные растворы кислоты и щелочи, выдержанные при комнатной температуре; температуру Т записать. В воде аммиак и ионы аммония находятся в динамическом равновесии. О химических свойствах аммиака, о его реакции с другими веществами — говорим ниже. Следующая статья.
Избыток аммиака наносит вред растительности и невероятно токсичен для водных организмов, особенно при повышенных уровнях pH и температуры. Для различных применений аммиак растворяют в воде для получения «водного аммиака». Водные растворы аммиака водный аммиак довольно нестабильны — концентрация аммиака может снизиться во время транспортировки или во время хранения.
В то время как аммиак представляет собой нейтральную не ионизированную молекулу слабощелочная , аммоний - это ион, несущий положительный заряд. Кроме того, аммиак издает резкий характерный запах, а вот аммоний совсем не пахнет. Основным фактором, определяющим соотношение аммиака к аммонию в воде, является водородный показатель pH. На активность аммиака также влияют ионная сила и температура раствора. Важно помнить, что, хотя аммиак вреден для водных организмов, ион аммония в основном безвреден.
В водном хозяйстве очень важно знать концентрации связанного с водородом азота. Когда уровень pH низкий, равновесие смещается вправо, а когда высокий, равновесие смещается влево. При pH около 8 доля NH 3 составляет 10 процентов или меньше, а при pH немного выше 9 - около 50 процентов. Активность водного аммиака намного ниже при низких температурах.
Аммиак используется и как реагент, и как один из основных параметров при контроле качества очистки воды и сточных вод. Хотя в целом аммиак безвреден при низких концентрациях, высокие концентрации могут причинить вред и представлять опасность для здоровья.
Следовательно, уровень аммиака необходимо надлежащим образом контролировать и поддерживать в рамках установленных законодательством. В ассортименте Hach вы найдете испытательное промышленное и лабораторное оборудование, реагенты и программное обеспечение, необходимое для точного контроля и управления уровнями аммиака в любом технологическом процессе.
Ноябрь 24, Читать далее.

Сентябрь 01, Читать далее. Июль 23, Читать далее. Апрель 05, Читать далее. Февраль 17, Читать далее. Январь 30, Читать далее. Январь 11, Читать далее. Октябрь 20, Читать далее. Февраль 10, Читать далее.
Январь 28, Читать далее. Январь 27, Читать далее. Январь 25, Читать далее. Январь 24, Читать далее. Январь 23, Читать далее. Январь 20, Читать далее. Декабрь 27, Читать далее. Декабрь 21, Читать далее.
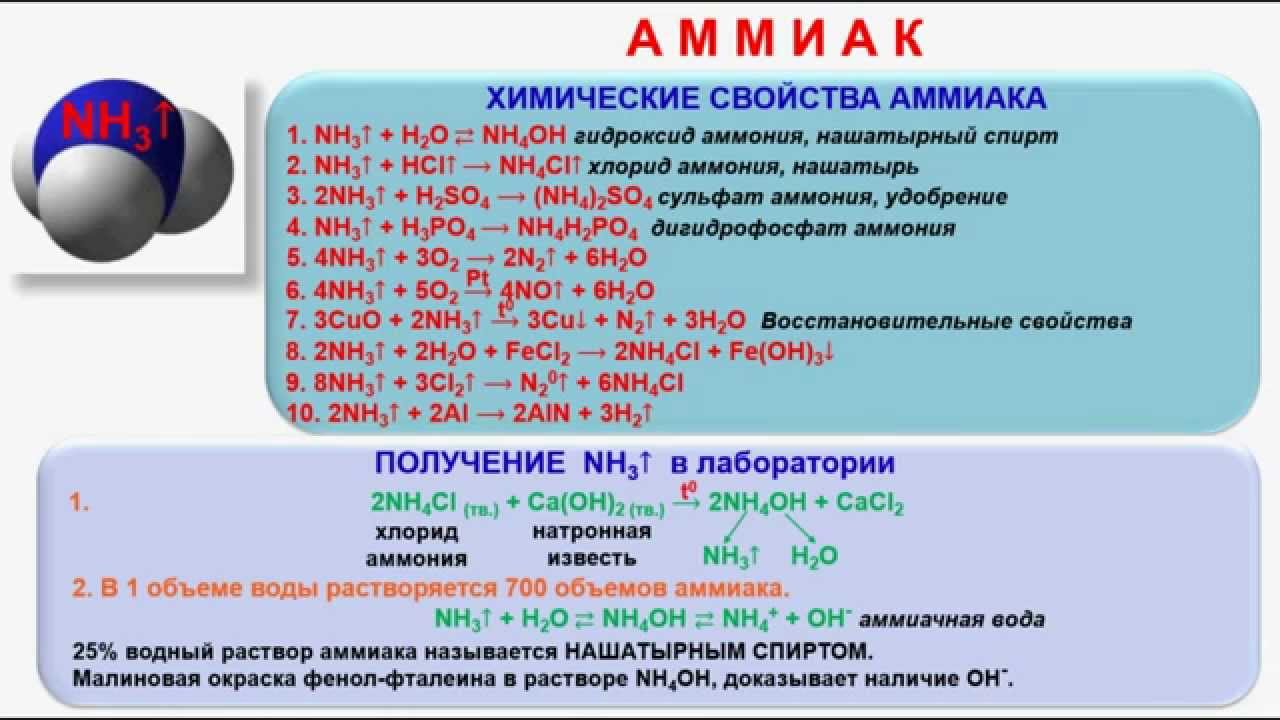
Вещество используется для медицинских и бытовых нужд. О химических свойствах аммиака, о его реакции с другими веществами — говорим ниже.
Формула раствор аммиака — NH 4 OH. Нашатырный спирт — гидрат или гидроксид аммиака. Нашатырный спирт также называется аммиачной водой или едким аммиаком. Это бесцветная прозрачная жидкость с резким запахом. Аммиак отлично растворяется в воде. В одном объёме воды при комнатной температуре можно растворить объёмов аммиака. При увеличении объёма воды и уменьшении количества аммиака плотность раствора увеличивается.
При нагревании концентрированного раствора растворимость NH 3 уменьшается, так как аммиак переходит в газообразное состояние. Реакция образования нашатырного спирта обратима, гидроксид аммония находится в равновесии с аммиаком. Именно поэтому нашатырный спирт имеет резкий аммиачный запах. Раствор обладает слабыми щелочными свойствами. При этом гидроксид аммония может проявлять свойства растворимого и нерастворимого основания.