Круговорот азота в природе кратко, Круговорот углерода, азота, фосфора, кислорода,воды

Второй путь возвращения углерода — разложение органического вещества. Многими исследователями доказано, что миграция полуторных окислов в условиях промывного типа водного режима происходит в виде высокодисперсных золей, стабилизированных кислым гумусом. Другие редуценты образуют оксиды азота, которые непосредственно усваивают растения. Человек уникален не только тем, что его организм нуждается в 40 элементах, но и тем, что в своей деятельности использует почти все другие имеющиеся в природе элементы. PPt 4 Web Хостинг презентаций.
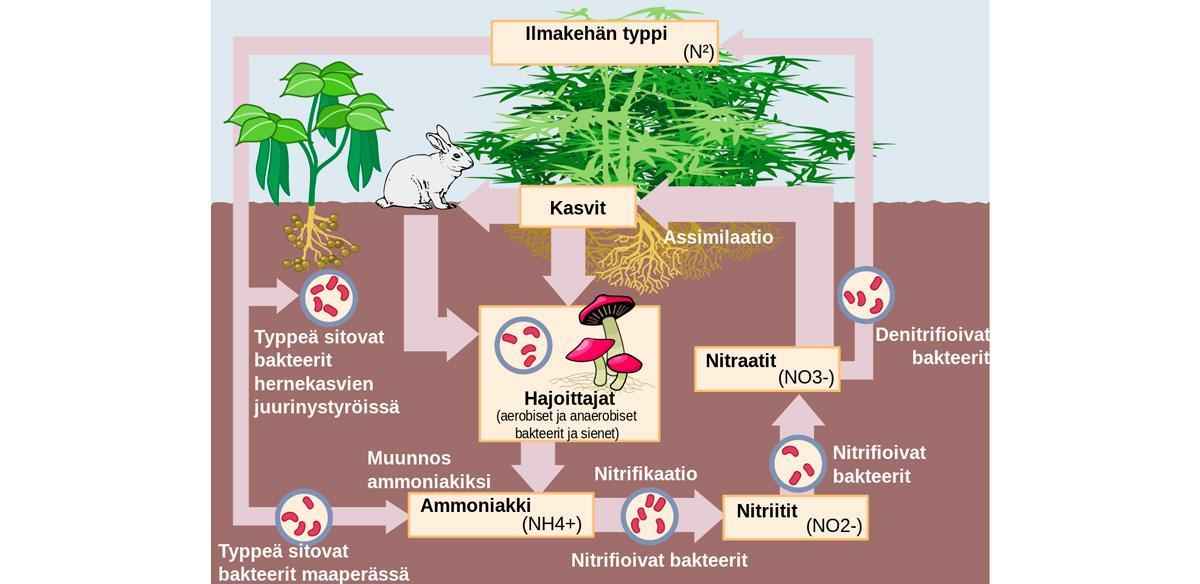
Растения усваивают фиксированный азот из почвы двумя способами: непосредственно или при помощи симбиоза с клубеньковыми бактериями. Аминокислоты и, соответственно, белки, имеют в своем составе азот.

Когда происходит обмен веществ, соединения, содержащие азот, распадаются до мочевины, аммиака, мочевой кислоты — дальше они выделяются в окружающую среду. Дальше дело за редуцентами. Одни из них разлагают такие соединения до того момента, пока не образуется молекулярный азот, попадающий в атмосферу. Другие редуценты образуют оксиды азота, которые непосредственно усваивают растения.
Таким образом происходит круговорот азота в биосфере. Химический состав живых организмов.
Современные методы лечения в ветеринарии. Ответить на вопррсы. Гельминты бесхвостых земноводных Турции и России. Удивительный мир бабочек. Справочник Онлайн-калькуляторы Тесты с ответами. Помощь студентам Справочник Биология Общая биология Круговорот веществ в биосфере. Как работает сервис.
Что мы имеем в виду, когда говорим о круговороте веществ в природе? Кратко о круговороте веществ в биосфере Для начала разберемся с понятием круговорота. Круговорот воды Едва ли не самым важным является круговорот веществ в сообществе водоема, поскольку вода — самое распространенное химическое соединение. Замечание 1 Вода — первичная среда обитания живых организмов: зарождение жизни произошло в гидросфере. Круговорот кислорода В природе осуществляется круговорот кислорода: он выполняет в биосфере уникальную роль.
Замечание 2 Растворенный в воде и находящийся в атмосфере кислород может участвовать в процессе окисления неорганических соединений оболочек Земли. Круговорот углерода Углерод — важнейших органогенный элемент: он есть в составе всех органических веществ и соединений. Это такие породы как: уголь; сланец; торф; нефть; газ. Замечание 3 Происходит нарушение равновесия в обмене углеродом между биосферой и прочими земными оболочками.
Круговорот азота Большая часть воздуха атмосферы — это свободный молекулярный азот. Определение 1 Фиксированный азот — азот, присутствующий в составе химических соединений, которые после могут использоваться живыми организмами. Всё ещё сложно? Все услуги. Предыдущая статья Популяционная структура вида Следующая статья Движение организмов. Выполненные работы по биологии. Химический состав живых организмов Вид работы: Доклад Выполнена: 9 сентября г.
Стоимость: руб Заказать такую же работу. Современные методы лечения в ветеринарии Вид работы: Доклад Выполнена: 16 июня г. Стоимость: 1 руб Заказать такую же работу.
Ответить на вопррсы Вид работы: Билеты к экзаменам Выполнена: 6 июня г. Стоимость: 2 руб Заказать такую же работу. Удивительный мир бабочек Вид работы: Речь и презентация к диплому Выполнена: 13 мая г. Постоянно образуется газообразный водород и в результате некоторых химических реакций, а также в процессе жизнедеятельности бактерий, разлагающих органическое вещество в анаэробных условиях.
Организмы закрепляют водород в биосфере планеты, связывая его не только в органическом веществе, но и участвуя в фиксации водорода минеральным веществом почвы. При поглощении иона гидроксония некоторыми силикатами происходит их трансформация в глинистые минералы. Таким образом, как подчеркивал В. Добровольский, интенсивность продуцирования кислотных продуктов метаболизма является важным фактором гипергенного преобразования кристаллических горных пород и образования коры выветривания.
Из циклических процессов на поверхности Земли, в которых участвует водород, один из наиболее мощных — круговорот воды: ежегодно через атмосферу проходит более тысяч кубометров влаги. Для создания фитомассы Мировой суши, существовавшей до вмешательства человека, по данным В. Добровольского было расщеплено примерно 1,8х тонн воды и, соответственно, связано 0,3х тонн водорода.
В процессе круговорота воды в биосфере происходит разделение изотопов водорода и кислорода. Пары воды при испарении обогащаются легкими изотопами, поэтому атмосферные осадки, поверхностные и грунтовые воды также обогащены легкими изотопами по сравнению с океаническими водами, имеющими устойчивый изотопный состав. Биогеохимический цикл азота Азот и его соединения играют в жизни биосферы такую же важную и незаменимую роль, как и углерод.
Биофильность азота сравнима с биофильностью углерода. Индекс биогенного обогащения почв по отношению к земной коре, а растений по отношению к почвам составляет для азота и соответственно Ковда, Основным резервуаром азота в биосфере также является воздушная оболочка. Основной формой, в которой содержится азот в атмосфере, является молекулярная — N 2. В качестве несущественной примеси в атмосфере содержатся различные оксидные соединения азота NO x , а также аммиак NH 3. Последний в условиях земной атмосферы наиболее неустойчив и легко окисляется.
В то же время, величина окислительно-восстановительного потенциала в атмосфере недостаточна и для устойчивого существования оксидных форм азота, потому его свободная молекулярная форма и является основной.
Первичный азот в атмосфере, вероятно, появился в результате процессов дегазации верхней мантии и из вулканических выделений. Этот азот также включается в общий биогеохимический поток растворенных соединений, мигрирующих с водными массами, участвует в почвообразовательных процессах и в формировании биомассы растений.
В отличие от углерода, атмосферный азот не может напрямую использоваться высшими растениями. Поэтому ключевую роль в биологическом круговороте азота играют организмы-фиксаторы. Это микроорганизмы нескольких различных групп, обладающие способностью путём прямой фиксации непосредственно извлекать азот из атмосферы и, в конечном счёте, связывать его в почве.
К ним относятся: некоторые свободноживущие почвенные бактерии; симбионтные клубеньковые бактерии существующие в симбиозе с бобовыми ; цианобионты, которые также бывают симбионтами грибов, мхов, папоротников, а иногда и высших растений.
В результате деятельности организмов — фиксаторов азота он связывается в почвах в нитритной форме соединения на основе NH 3. Нитритные соединения азота способны мигрировать в водных растворах. При этом они окисляются и преобразуются в нитратные — соли азотной кислоты HNO 3. В этой форме азотные соединения способны эффективно усваиваться высшими растениями и использоваться для синтеза белковых молекул на основе пептидных связей C-N.
Далее, по трофическим цепям, азот попадает в организмы животных. В окружающую среду в водные растворы и в почву он возвращается в процессах выделительной деятельности животных или разложения органического вещества. Возврат свободного азота в атмосферу, как и его извлечение, осуществляется в результате микробиологических процессов.
Это звено круговорота функционирует благодаря деятельности почвенных бактерий-денитрификаторов, вновь переводящих азот в молекулярную форму.
В литосфере, в составе осадочных отложений, связывается весьма небольшая часть азота. Причина этого в том, что минеральные соединения азота, в отличие от карбонатов, очень хорошо растворимы. Выпадение некоторой доли азота из биологического круговорота также компенсируется вулканическими процессами. Благодаря вулканической деятельности в атмосферу поступают различные газообразные соединения азота, который в условиях географической оболочки Земли неизбежно переходит в свободную молекулярную форму.
Таким образом, основными специфическими чертами круговорота азота в биосфере можно считать следующие: преимущественную концентрацию в атмосфере, играющей исключительную роль резервуара, из которой живые организмы черпают запасы необходимого им азота; ведущую роль в круговороте азота почв и, в особенности, почвенных микроорганизмов, деятельность которых обеспечивает переход азота в биосфере из одних форм в другие рис. Схема биогеохимического цикла азота Поэтому огромное количество азота в связанном виде содержит биосфера: в органическом веществе почвенного покрова 1,5х10 11 т , в биомассе растений 1,1х10 9 т , в биомассе животных 6,1х10 7 т.
В больших количествах азот содержится и в некоторых биогенных ископаемых селитры. В то же время наблюдается парадокс — при огромном содержании азота в атмосфере вследствие чрезвычайно высокой растворимости солей азотной кислоты и солей аммония, азота в почве мало и почти всегда недостаточно для питания растений. Поэтому потребность культурных растений в азотных удобрениях всегда высока.
Поэтому ежегодно в почву вносится по разным оценкам от 30 до 35 млн. Это часто приводит к существенному загрязнению окружающей среды и тяжелым заболеваниям человека и животных. Существенным нарушением цикла азота является и все возрастающее количество отходов животноводства, промышленных отходов и стоков больших городов, поступление в атмосферу аммония и оксидов азота при сжигании угля, нефти, мазута и т. Опасно проникновение оксидов азота в стратосферу выхлопы сверхзвуковых самолетов, ракет, ядерные взрывы , так как это может быть причиной разрушения озонового слоя.
Все это, естественно, сказывается на биогеохимическом цикле азота. Биогеохимический цикл серы Сера также является одним из элементов, играющих чрезвычайно важную роль в круговороте веществ биосферы. Она относится к числу химических элементов, наиболее необходимых для живых организмов. В частности, она является компонентом аминокислот. Она предопределяет важные биохимические процессы живой клетки, является незаменимым компонентом питания растений и микрофлоры.
Соединения серы участвуют в формировании химического состава почв, в значительных количествах присутствуют в подземных водах, что играет решающую роль в процессах засоления почв. Однако, в засоленных почвах содержание серы может достигать значений, измеряемых целыми процентами. Таким образом, основным резервуаром, из которого она черпается живыми организмами, является литосфера. Это обусловлено тем, что устойчивое существование сернистых соединений в условиях современной атмосферы Земли, содержащей свободный кислород и пары Н 2 О, невозможно.
Сероводород H 2 S в кислородной среде окисляется, а кислородные соединения серы, реагируя с Н 2 О, образуют серную кислоту H 2 SO 4 , которая выпадает на поверхность Земли в составе кислотных дождей. Поэтому оксиды серы SO х , хотя и могут усваиваться растениями непосредственно из атмосферы, существенной роли в круговороте серы этот процесс не играет. В результате биологических и биогеохимических процессов происходит изменение в соотношении этих изотопов в сторону увеличения содержаний более легкого изотопа в верхних гумусовых горизонтах почв.
Изотопный состав серы подземных, почвенно-грунтовых вод и водорастворимых сульфатов из горизонта С сульфатно-содовых солончаков является сходным.
В составе земной коры соединения серы существуют, в основном, в двух минеральных формах: сульфидной соли сероводородной кислоты и сульфатной соли серной кислоты. Редко встречается самородная сера, которая неустойчива и склонна, в зависимости, от значений окислительно-восстановительного потенциала среды, формировать или кислородные, или водородные соединения.
Первичной, глубинной по происхождению, минеральной формой нахождения серы в земной коре, является сульфидная. Сульфидные соединения в условиях биосферы практически нерастворимы, и потому сульфидная сера растениями не усваивается.
Но, в то же время, сульфиды в кислородной среде неустойчивы. Поэтому сульфиды на земной поверхности, как правило, окисляются, и в результате этого сера входит в состав сульфатных соединений. Сульфатные соли обладают достаточно хорошей растворимостью, и сера в географической оболочке активно мигрирует в водных растворах в составе сульфат-иона SO 4 Именно в этой, сульфатной форме сера, в составе водных растворов, эффективно усваивается растениями, а далее — животными организмами.
Усвоению способствует то, что сульфатные соединения серы способны накапливаться в почвах, участвуя в процессах обменной сорбции и входя при этом в состав почвенного поглощающего комплекса ППК. Разложение органического вещества в кислородной среде приводит к возвращению серы в почву и природные воды.
Сульфатная сера мигрирует в водных растворах, и может снова использоваться растениями. Если же разложение идёт в бескислородной среде, ведущую роль играет деятельность серобактерий, которые восстанавливают SO 4 2- до H 2 S.
Сероводород выделяется в атмосферу, где окисляется и возвращается в другие компоненты биосферы в сульфатной форме. Часть серы в восстановительной обстановке может связываться в сульфидных соединениях, которые, при возобновлении доступа кислорода, снова окисляются и переходят в сульфатную форму.
Биогеохимический цикл серы состоит из 4 стадий рис. Превращение органической серы живыми организмами животными и бактериями в конечный продукт — сероводород. Окисление минеральной серы живыми организмами серобактериями, тионовыми бактериями в процессе сульфатредукции. На этой стадии происходит окисление сероводорода, элементарной серы, ее тио- и тетрасоединений. Восстановление минеральной серы живыми организмами бактериями в процессе десульфофикации до сероводорода.
Таким образом, важнейшим звеном всего биогеохимического цикла серы в биосфере является биогенное образование сероводорода. Схема биогеохимического цикла серы Изъятие серы из биосферного круговорота происходит в результате накопления сульфатных отложений в основном гипсовых , слои и линзы которых становятся компонентами литосферы.
Компенсируются потери во-первых, в процессах вулканизма поступление H 2 S и SO x в атмосферу, а оттуда, с атмосферными осадками — на поверхность Земли. А во-вторых, в результате деятельности термальных вод, с которыми в верхние горизонты земной коры и на дно Мирового океана поступают сульфидные соединения. Таким образом, к характерным особенностям круговорота серы можно отнести второстепенную роль процессов атмосферной миграции, а также многообразие форм нахождения, обусловленное переходом её из сульфидных форм в сульфатные и обратно, в зависимости от изменения окислительно-восстановительных условий.
Промышленные процессы выносят в атмосферу большое количество серы. В отдельных случаях значительная концентрация соединений серы в воздухе служит причиной нарушений в окружающей среде, в том числе, кислотных дождей. Присутствие в воздухе двуокиси серы негативно влияет как на высшие растения, так и на лишайники, причем эпифитные лишайники могут служить индикаторами повышенных содержаний серы в воздухе. Лишайники поглощают влагу из атмосферы всем слоевищем, поэтому концентрация серы в них быстро достигает предельно допустимого уровня, что ведет к гибели организмов.
Поступление серы в общий круговорот по данным Дж. Таким образом, антропогенное поступление серы в биосферу существенно изменяет круговорот этого элемента, а приход серы в биосферу превышает ее расход, в результате чего, должно происходить постепенное ее накопление. Биогеохимический цикл фосфора. Круговорот фосфора в природе сильно отличается от биогеохимических циклов углерода, кислорода, азота и серы, так как газовая форма соединений фосфора например РН 3 практически не участвует в биогеохимическом цикле фосфора.
То есть фосфор к накоплению в атмосфере вообще не способен. Поэтому роль «резервуара» фосфора, из которого этот элемент извлекается и используется в биологическом круговороте, так же как и для серы, играет литосфера. Фосфор в литосфере содержится в форме фосфатных соединений солей фосфорной кислоты. Основная доля среди них приходится на фосфат кальция — апатит. Это полигенный минерал, образующийся в различных природных процессах — как в глубинных, так и в гипергенных в том числе и биогенных.
Фосфатные соединения способны растворяться в воде, и фосфор в составе иона РО 4 3- может мигрировать в водных растворах. Из них фосфор и усваивается растениями. Индекс биогенного обогащения почв по отношению к земной коре, а растений по отношению к почвам составляет для фосфора, так же, как и для азота и соответственно Ковда, Для растений наиболее доступным является фосфор неспецифических органических соединений и гумуса и именно он играет главную роль в малом локальном биологическом цикле фосфора.
Животные являются еще большими концентраторами фосфора, чем растения. Многие из них накапливают фосфор в составе тканей мозга, скелета, панцирей.. Есть несколько способов усвоения фосфора организмами-консументами. Во-первых, прямое усвоение из растений в процессе питания.
Во-вторых, водные организмы-фильтраторы извлекают фосфор из органических взвесей. В-третьих, органические соединения фосфора усваиваются организмами-илоедами при переработке ими биогенных илов. Возврат фосфора в окружающую среду происходит при разложении органического вещества.
Но возврат этот оказывается далеко не полным. В целом для соединений фосфора характерна тенденция выноса в форме водных растворов и взвесей в конечные водоёмы стока, в наибольшей мере — в Мировой Океан, где он и накапливается в составе осадочных отложений различного генезиса.
Вновь вернуться в экзогенный круговорот эта часть фосфора может только в результате тектонических процессов, растягивающихся на сотни миллионов лет. В естественных условиях сохранение баланса обеспечивается сравнительно слабой подвижностью соединений фосфора, в результате которой фосфор, извлечённый растениями из почвы, большей частью возвращается в неё в результате разложения органического вещества. В почвах и породах фосфор достаточно легко фиксируется.
Фиксаторами фосфора являются гидроксиды железа, марганца, алюминия, глинистые минералы особенно, минералы группы каолинита. Этот процесс зависит от рН и Eh условий среды. Повышенная кислотность, образование угольной кислоты, способствуют десорбции фосфора, усилению миграции фосфорных соединений. В восстановительной среде образуются соединения фосфора с двухвалентным железом, что тоже способствует выносу фосфора из почвы.
Миграция фосфора возможна и за счет водной и ветровой эрозии. Поэтому биогеохимический цикл фосфора значительно менее замкнут и менее обратим, чем циклы углерода и азота, а загрязнение фосфором окружающей среды особенно опасно рис. Схема биогеохимического цикла фосфора Основными особенностями круговорота фосфора, таким образом, являются: отсутствие атмосферного переноса; наличие единственного источника — литосферы; тенденция к накоплению в конечных водоёмах стока.
При интенсивной сельскохозяйственной эксплуатации земель потери фосфора в ландшафте становятся практически необратимыми. Компенсация возможна только за счёт применения фосфорных удобрений. Известно, что фосфорные удобрения являются важным и необходимым звеном в получении высоких урожаев сельскохозяйственных культур. Однако, все известные запасы месторождений фосфатов ограничены и по предсказаниям ученых могут истощиться уже в ближайшие лет. В то же время, вредные соединения фосфатов в последнее время становятся одним из важнейших факторов загрязнения речных и озерных вод.
Таким образом, в последе время общая картина распределения им миграции фосфора в биосфере резко нарушена человеком. Вот слагаемые этого явления: во-первых, мобилизация фосфора из агроруд и шлаков, производство и применение фосфорных удобрений, во-вторых производство фосфорсодержащих препаратов и их использование в быту; в-третьих — производство фосфорсодержащих ресурсов продовольствия и кормов, вывоз и потребление их в зонах концентрации населения; в-четвертых — развитие рыбного промысла, добыча морских моллюсков и водорослей, что влечет за собой перераспределение фосфора из океана на сушу.
В итоге наблюдается процесс фосфатизации суши, но процесс этот проявляется крайне неравномерно. Увеличивается содержание фосфора в окружающей среде больших городов. Напротив, страны, активно экспортирующие органические продукты и не применяющие фосфорных удобрений, теряют запасы фосфора в своих почвах.
Биогеохимические циклы калия и натрия Кларк калия в земной коре составляет 2,89, а натрия 2, 46, т. Изотоп 40К неустойчив и превращается в соседние изобары кальция и аргона. Превращение калия в аргон явилось основой для разработки калий-аргонового метода ядерной геохронологии. Космическая распространенность калия, как элемента нечетного, невелика по сравнению с четными кальцием и кислородом. По размерам ион калия наиболее крупный среди других ведущих катионов литосферы.
Поэтому объемный кларк калия занимает второе место после кислорода в земной коре. Калий — химически активный металл, в самородном состоянии не встречается. Во всех химических соединениях на Земле выступает как одновалентный металл.
Металлический калий на воздухе «сгорает», быстро окисляясь до К 2 О. Число минеральных видов — втрое меньше, чем у кальция и вдвое меньше, чем у натрия.. Важнейшие минералы: галоиды — сильвин, карналлит, нитраты — К-селитра, силикаты — К-полевые шпаты ортоклаз, микроклин , флогопит, мусковит, биотит, глауконит, лейцит. По химическим свойствам калий близок к натрию, что определяет их совместную миграцию.
Но их поведение в зоне гипергенеза и биосфере в целом резко различно. Большая часть калия в ходе гипергенного преобразования силикатов остается в составе вторичных глинистых минералов, поэтому калий гораздо прочнее удерживается в пределах Мировой суши, чем натрий и ,как мы увидим далее, кальций. И все же частичное высвобождение ионов калия в процессах гипергенеза происходит и он активно вовлекается в биогеохимический круговорот.
Обусловлено это тем, что калий играет очень важную роль в жизни живых организмов. В условиях влажного климата при выветривании калийсодержащих минералов калий легко выщелачивается и переносится водными растворами.
Однако вынос калия в коре выветривания происходит менее интенсивно, чем кальция и натрия. Это связано с тем, что крупный ион калия в большей степени сорбируется тонкодисперсными минералами. Давно известно, что ионы калия легче сорбируются и некоторыми коллоидами например, гидроокислами железа и алюминия , чем ионы натрия. Реакции катионного обмена с глинистыми минералами также способствуют фиксации калия. В почвах также происходит обмен между ионами калия и гидроксония, которые имеют сопоставимые ионные размеры.
Таким способом калий может фиксироваться в гидрослюдах, каолините, монтмориллоните. Калий в большей степени, чем натрий, поглощается наземной растительностью.
Поэтому значительная часть калия сохраняется в почвах, в то время как большая часть натрия выносится в океан. В составе стока с материков натрия почти в 2,5 раза больше, чем калия.
Калий — важнейший элемент живых организмов. Некоторые организмы способны концентрировать калий в значительных количествах. Наземные растения поглощают калий из почвы. При недостатке калия листья бледнеют и отмирают, семена теряют всхожесть. Калий легко проникает в клетки организмов и увеличивает их проницаемость для различных веществ. Он оказывает значительное влияние на обмен веществ и необходим растениям для фотосинтеза..
Кроме того, калий улучшает поступление воды в клетки растений и понижает процесс испарения, тем самым увеличивая устойчивость растений к засухе. При недостатке или избытке калия интенсивность фотосинтеза снижается, а интенсивность дыхания повышается.
Недостаток калия в почвах приводит к значительному снижению урожайности растений. Именно поэтому кларк калия в живом веществе такой же высокий, как у азота. В биологический круговорот на суше вовлекается ежегодно около 1,8х тонн калия Добровольский, Освобождающаяся из системы биологического круговорота на суше масса калия частично задерживается в мертвом органическом веществе и сорбируется минеральным веществом почвы глинистыми минералами , а частично вовлекается в водную миграцию.
Количество калия в настоящее время связанное в мертвом органическом веществе педосферы составляет по данным разных авторов от 3х до 6х тонн. Ежегодно с континетальным водным стоком в океан поступает более 61х тонн калия в растворенном состоянии виде свободных ионов и х тонн калия в составе взвесей глинистые частицы, органическое вещество и т. Значительное количество калия переносится с пылью с суши в океан. По оценке В. Добровольского эта величина составляет не менее 43х10 6 тонн в год.
В гипергенной зоне крупные концентрации калия встречаются редко и представлены эвапоритами — сильвином и карналлитом. Еще реже встречаются нитраты калия в виде калиевой селитры органогенного происхождения образуется в условиях аридного климата. Кларк натрия в живом веществе очень низок — 0, более чем на два порядка ниже, чем у калия , что свидетельствует о низком потреблении натрия живым веществом.
Однако, в малых количествах натрий необходим всем живым организмам. В условиях влажного климата натрий легко выходит из биологического круговорота и выносится с жидким стоком за пределы ландшафта. В результате наблюдается общее обеднение последнего натрием. Содержание натрия в растительных организмах обычно очень низкое.
Животные организмы нуждаются в повышенных количествах этого элемента.

Влияет на деятельность сердечно-сосудистой системы и почек. Поэтому животные иногда нуждаются в подкормке поваренной солью. В сухом климате натрий концентрируется в грунтовых и озерных водах и накапливается в солончаковых почвах действие испарительного барьера.
Соответственно, и растительность галофитных сообществ содержит повышенные количества натрия. Тем не менее, роль биологического круговорота натрия, в отличие от калия, сравнительно невелика. Зато очень значительна его водная миграция. По особенностям миграции в биосфере натрий весьма схож с хлором. Он образует легко растворимые соли, поэтому накапливается в Мировом океане, участвует в атмосферной миграции.
Основной источник подвижного натрия в биосфере — выветривающиеся изверженные породы основной источник хлора — вулканизм. Техногенез внес существенные коррективы в биогеохимические пути миграции натрия. Основное значение имеет добыча галита поваренной соли , соды и мирабилита. На характер биогеохимических циклов натрия существенное влияние оказывает и орошение земель в засушливых районах.
Биогеохимические циклы кальция и магния. Атомы кальция содержат магическое число протонов: 20 в ядре и это определяет прочность его ядерной системы. По распространению в Солнечной системе он занимает 15 место, но среди металлов находится на 5 месте. В природе он ведет себя как химически активный металл.
Легко окисляется с образованием СаО. Число минеральных видов — , поэтому он относится к главным минералообразующим элементам. По числу образуемых минералов он занимает 4 место после кислорода, водорода и кремния. Например: карбонаты — кальцит, арагонит, доломит; сульфаты — ангидрит, гипс; галоиды- флюорит; фосфаты: апатит; силикаты — гранаты, пироксены, амфиболы, эпидот, плагиоклазы, цеолиты. Плагиоклазы — наиболее распространенные минералы земной коры. Кларк кальция в литосфере составляет 2, Кальциевые силикаты слабо устойчивы в зоне гипергенеза и при выветривании горных пород разрушаются в первую очередь.
Кальций обладает относительно высокой миграционной способностью, во многом определяемой особенностями климата. В процессах химического выветривания кальций выщелачивается из минералов природными водами. По отношению к выветриванию кальциевые минералы образуют следующую последовательность: плагиоклаз — кальциевый авгит- кальциевый амфибол.
В группе плагиоклазов богатые кальцием разности выветриваются скорее, чем натриевые. При этом природные растворы, энергично удаляющие кальций, содержат значительные количества гидрокарбонатного иона. Зато в почвах гумидных зон наблюдается значительный дефицит кальция.
Очень мало его и в корах выветривания. Объясняется это высокой миграционной подвижностью данного элемента. В ионном стоке с материков кальций занимает первое место среди катионов. Реками он выносится главным образом в виде взвесей карбонатов, сульфатов и бикарбоната в растворенном состоянии. Геохимическая история кальция в океане связана с карбонатной системой равновесия, температурой воды и деятельностью живых организмов.
Кальций — один из важнейших элементов живых организмов — от простейших до высших млекопитающих. Холодные воды высоких широт и морские глубины недосыщены СаСО 3 из-за низких температур и рН, поэтому содержащаяся в воде угольная кислота растворяет СаСО 3 донных отложений. Именно поэтому морские организмы в высоких широтах избегают строить свои скелеты из СаСО 3.
В экваториальных широтах установлена область пересыщения СаСО 3. Здесь наблюдается массовый рост коралловых рифов, у многих живущих здесь организмов массивные карбонатные скелеты и раковины. Миграция кальция в океане с участием живых организмов — наиболее важное звено в его круговороте.
Куда же он делся?. Примерно столько же его ежегодно захороняется в донных отложениях океана. Живые организмы океана концентрируют кальций в виде арагонита и кальцита. Арагонит, однако, неустойчив и со временем переходит в кальцит. В океане мы сталкиваемся с уникальными явлениями быстрого роста крупных кристаллов в отдельных организмах.
В некоторых раковинах двустворчатых моллюсков встречаются кристаллы кальцита длиной более 7 см, в тропических морях обитают морские ежи , имеющие длинные иголки из кальцита. У многих иглокожих наблюдается адаптация живого тела организмов к форме кристаллов. В этом случае мы встречаем особый вид симбиоза между организмами и кристаллами.
В аридном климате кальций легко выпадает из растворов в виде карбонатов, формируя толщи хемогенных карбонатных пород и иллювиально-карбонатные горизонты в почвах. Небольшая часть ионов кальция морской воды осаждается в замкнутых водоемах в эвапоритовых условиях химическим путем.
Кальций играет важную роль в процессах почвообразования. Он входит в состав почвенно-поглощающего комплекса, участвует в обменных реакциях почвенного раствора, обусловливая буферную способность почв в кислом интервале среды. Гуматы кальция играют важную роль в формировании структуры почвы. Кроме того, кальций активно участвует в процессах осаждения полуторных окислов, марганца, нередко образуя конкреции совместно с этими элементами и кремнеземом. В почвах кислого ряда, характеризующихся значительным проявлением процесса выщелачивания, наблюдается явление биогенного накопления кальция в подстилке и аккумулятивных поверхностных горизонтах почв.
Он входит в группу элементов-биофилов. Поэтому кальций активно участвует в биологическом круговороте. Масштабы вовлечения кальция значительно различаются в разных природных зонах.
В агроландшафтах значительная часть кальция отчуждается вместе с урожаем. Но нарушение биогеохимического круговорота кальция в настоящее время происходит не только и не столько за счет отчуждения части его с сельскохозяйственной продукцией, но и за счет использования карбонатных пород в строительстве, сельском хозяйстве известкование почв , металлургической промышленности.
Клак магния уступает кларку кальция и составляет 1,87, но распределение магния очень неоднородно.