Гидролиз солей 11 класс

Нерастворимые соли не подвергаются гидролизу. Взаимное усиление гидролиза Гидролиз органических веществ. Посмотрите видео-объяснение темы Преподаватель Фоксфорда всё подробно расскажет и покажет.
Такое взаимодействие нередко приводит к реакции гидролиза от др.
Гидролиз — это химическая реакция взаимодействия вещества с водой, при которой происходит разложение молекул этого вещества и воды с образованием новых соединений. Гидролиз соединений различных классов — солей, углеводов, галогеналканов, белков, сложных эфиров в том числе жиров и др.
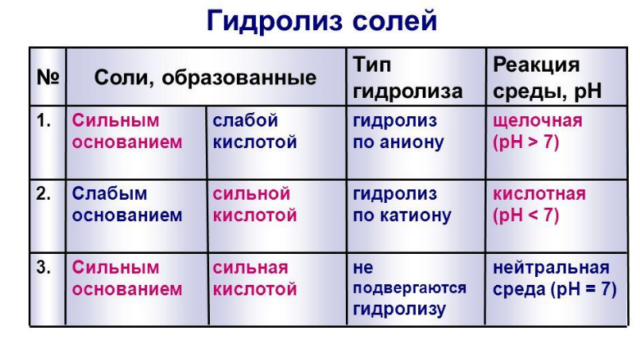
С гидролизом галогеналканов, белков полипептидов , ди- и полисахаридов на примере сахарозы, крахмала и целлюлозы , а также сложных эфиров вы познакомились в курсе органической химии. В этом разделе мы рассмотрим гидролиз неорганических веществ — солей. Гидролиз солей — это обменное взаимодействие между молекулами воды и катионами или анионами соли, приводящее к образованию слабых электролитов.
Анионы слабых кислот, взаимодействуя с катионами водорода, могут образовывать слабо диссоциирующие молекулы кислоты. Катионы слабых оснований, взаимодействуя с гидроксид-ионами, могут образовывать малодиссоциирующие основания.
Отличие среды раствора соли от нейтральной — один из признаков гидролиза соли. Насколько велико это отличие, а также кислым или щелочным является раствор соли, зависит от силы основания и кислоты, из которых эта соль образуется по реакции нейтрализации. Перейти к основному содержанию. Боковая панель. Вы используете гостевой доступ Вход. Печатать книгу. Печатать эту главу. Гидролиз солей. Понятие о реакциях гидролиза В водном растворе частицы растворённого вещества взаимодействуют с молекулами воды.
Перейти на Форзац 1 Форзац 2 Вступительное слово Глава I. Простые и сложные вещества. Основные законы химии. Закон постоянства состава вещества.

Молярная концентрация газа Глава II. Значение периодического закона и периодической системы Д. Менделеева для развития науки Глава III. В настоящее время очень много различного методического и дидактического материала по химии.
Многие авторы создали тетради на печатной основе, которыми можно пользоваться на уроках и дома. Но в условия Опорный конспект к уроку химии в 11 классе "Химическое равновесие.

Условие его смещения". Его так же можно применять и при изучении этой же темы в 9 классе Опорный конспект к уроку химии в 10 классе "Химические свойства одноатомных спиртов" Опорные конспекты, логико-структурные схемы, схемы-программы, обобщающие и проверочные опорные конспекты для оптимизации процесса обучения.
Учебные схемы позволяют развивать мыслительные операци В этом материале блочно даются химические свойства некоторых металлов, не металлов и органических веществ.
Удачи в изучении такой интересной науки, как химия. Современная школе страдает от перегрузки учебных программ: один предмет сменяется другим в течение дня, на изучение некоторых из них отведен всего один час в неделю, хотя уровень сложности изучаемого Сайты образовательных учреждений Сайты коллег Форумы. Опубликовано Предварительный просмотр: Гидролиз солей Гидролиз солей - это разложение вещества при взаимодействии с водой соль должна быть растворима!
Среды этих растворов может быть нейтральной чаще всего , слабокислой или слабощелочной 4 Гидролиз невозможен IV тип Соль, образованная сильным основанием и сильной кислотой KBr , NaCl , NaNO 3 , гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется.
По теме: методические разработки, презентации и конспекты Опорные конспекты к урокам химии в 8 классе.