Фосфор электронная конфигурация, Задание 1 ЕГЭ по химии теория и практика

Электронная конфигурация фосфора в возбужденном состоянии: При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Такой «паспорт» называется электронной конфигурацией. При очень высоком давлении фосфор переходит в новую модификацию — металлический фосфор , который очень хорошо проводит электрический ток. Качественные реакции органических соединений Задание
Но мы ждать точно не будем, когда там учёные договорятся, поэтому рассмотрим основные четыре вида. Самое главное, что нужно по ним запомнить, что от белого фосфора к металлическому снижается химическая активность. Нарастают металлические свойства, особенно электропроводимость. Самым химически активным будет белый фосфор. Бранд смог получить фосфор интересным способом. Сначала он выпарил мочу, а потом, образовавшийся, осадок стал нагревать с белым песком. Быстро и эффективно.
Так конечно уже никто не делает, но если что — метод рабочий. Основным же способом получения фосфора в промышленности является спекание фосфата кальция с керамзитом и углем. Пары белого фосфора скапливаются в приемник под водой. Фосфор можно получить и из других соединений, как пример:.
Рассмотрим некоторые из соединений фосфора. Какие-то из них мы уже встречали пока разбирали химические свойства химического элемента N Твердое вещество, белого цвета с неприятным запахом. Растворяется в воде с образованием кислоты:. Взаимодействует с основаниями, в итоге получается фосфит соль фосфористой кислоты и вода:. Внешне особо не отличается от предыдущего оксида.
Белое кристаллическое вещество. Но очень гигроскопичное, то есть оксид способен впитывать в себя водяные пары из воздуха.

С его помощью получают ангидриды кислот. Взаимодействует с оксидами металлов:.
Взаимодействует с щелочами:. Фосфор образует множество кислот, рассмотрим только самые популярные:. Бесцветное кристаллическое вещество. Сильная кислота.
Образует соли гипофосфиты. Кристаллическая, бесцветная. Обладает высокой гигроскопичность. Кислота средней силы.
Соли фосфиты или фосфонаты. Твердое кристаллическое вещество. Хорошо растворяется в воде и растворителях. Слабая кислота. Соли называются фосфаты или ортофосфаты. На ее примере рассмотрим некоторые химические реакции.
Кислоты взаимодействуют с металлами. Газ без цвета с отвратительным запахом, чем-то похожим на тухлую рыбу приправленную чесноком. Очень ядовит. Плохо растворяется в воде, но не может устоять перед органическими растворителями. Взаимодействует с кислотами:. Свойства фосфора таблица : температура, плотность, давление и пр. Физические свойства фосфора. Химические свойства фосфора.
Взаимодействие фосфора. Химические реакции с фосфором. Получение фосфора. Применение фосфора. Таблица химических элементов Д. Фосфор лат.

Phosphorus, от др. Менделеева с обозначением P и атомным номером Как простое вещество фосфор при нормальных условиях представляет собой твёрдое вещество белого, красного, фиолетового, черного или синего цвета. Все модификации фосфора различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный.
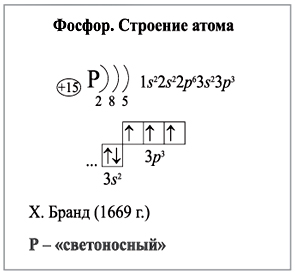
Электронная конфигурация атома фосфора 1s 2 2s 2 2p 6 3s 2 3p 3.
При этом 10 электронов находятся на внутреннем уровне, а 5 электронов — на внешнем. Поскольку фосфор расположен в третьем периоде, оболочек всего три. Первая — внутренняя оболочка представлена s-орбиталью.

Вторая — внутренняя оболочка представлена s- и р-орбиталями. Третья — внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома фосфора на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали — три неспаренных электрона. В свою очередь ядро атома фосфора состоит из 15 протонов и 16 нейтронов.